Kalmagiitti
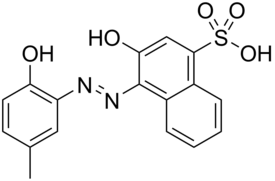
Kalmagiitti (C17H14N2O5S) on atsoväriaine ja kompleksometrinen indikaattori. Sitä käytetään analyyttisessä kemiassa metalli-ionien pitoisuuksien määrittämiseen.
| Kalmagiitti | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| IUPAC-nimi | (4Z)-4-[(2-hydroksi-5-metyylifenyyli)hydratsiinylideeni]-3-oksonaftaleeni-1-sulfonihappo |
| CAS-numero | |
| SMILES | CC1=CC(=C(C=C1)O)NN=C2C3=CC=CC=C3C(=CC2=O)S(=O)(=O)O[1] |
| Ominaisuudet | |
| Molekyylikaava | C17H14N2O5S |
| Moolimassa | 358,372 g/mol |
| Sulamispiste | 330 °C[2] |
| Liukoisuus veteen | 30 g/l[3] |
Ominaisuudet ja käyttö
muokkaaVapaassa muodossaan kalmagiitin väri riippuu liuoksen pH-arvosta. Kun pH on alle 5, on indikaattori väriltään punaista. Sinistä indikaattori on happamuusalueella 7–9 ja erittäin emäksisissä olosuhteissa punaoranssia. Kalmagiitti muodostaa useiden metalli-ionien kanssa väriltään viininpunaisen kompleksin.[4][5]
Kalmagiittia valmistetaan 1-amino-2-naftoli-4-sulfonihapon diatsoniumsuolan ja p-kresolin atsokytkentäreaktiolla[3].
Kalmagiittia käytetään indikaattorina kompleksometrisissä titrauksissa. Se soveltuu muun muassa veden kovuutta aiheuttavien kalsium- ja magnesiumionien määrittämiseen. Kalmagiitin etu toiseen tähän tarkoitukseen käytettyyn indikaattoriin eriokromimusta T:hen nähden on kalmagiittiliuoksien parempi säilyvyys ja selkeämpi ja terävämpi värinmuutos.[4][6] Kalmagiittimetallikompleksien pitoisuuksia voidaan määrittää myös spektrofotometrisesti.[7]
Lähteet
muokkaa- ↑ Calmagite – Substance summary NCBI. Viitattu 17.2.2011.
- ↑ Calmagite Sigma-Aldrich. Viitattu 17.2.2011. (englanniksi)
- ↑ a b Floyd J. Green: The Sigma-Aldrich Handbook of Stains, Dyes, and Indicators, s. 188. Aldrich Chemical Company, 1990. ISBN 0-941633-22-5 (englanniksi)
- ↑ a b Daniel C. Harris: Quantitative Chemical Analysis, s. 241–242. W.H. Freeman and Company, 2007. ISBN 978-0-7167-7041-1 (englanniksi)
- ↑ John R. Dean: Practical skills in chemistry, s. 151. Pearson Education, 2002. ISBN 978-0130280022 Kirja Googlen teoshaussa Viitattu 17.2.2011. (englanniksi)
- ↑ M. Cecilia Yappert & Donald B. DuPré: Complexometric Titrations: Competition of Complexing Agents in the Determination of Water Hardness with EDTA. Journal of Chemical Education, 1997, 74. vsk, nro 12, s. 1422. American Chemical Society. Artikkelin verkkoversio. Viitattu 17.2.2011. (englanniksi)
- ↑ Kenneth D. McClatchey: Clinical laboratory medicine, s. 401. Lippincott Williams & Wilkins, 2002. ISBN 978-0683307511 Kirja Googlen teoshaussa Viitattu 17.2.2011. (englanniksi)
Aiheesta muualla
muokkaa- Kuvia tai muita tiedostoja aiheesta Kalmagiitti Wikimedia Commonsissa