Rikkidikloridi
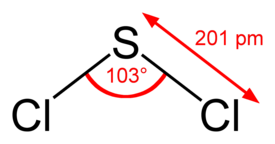
Rikkidikloridi (SCl2) on myrkyllinen rikin ja kloorin muodostama yhdiste. Se on yksinkertaisin kloorin sulfideista. Rikkidikloridia käytetään orgaanisessa synteesissä ja valmistettaessa muita rikin yhdisteitä. Huoneenlämpötilassa aine on punainen neste.
| Rikkidikloridi | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | SCl2 |
| Moolimassa | 102,97 g/mol |
| Ulkomuoto | Punainen neste |
| Sulamispiste | −78 °C [1] |
| Kiehumispiste | 59 °C (hajoaa) [1] |
| Tiheys | 3,6 g/cm3[1] |
| Liukoisuus veteen | Reagoi veden kanssa [1] |
Valmistus
muokkaaRikkidikloridia voidaan valmistaa rikistä ja kloorista. Reaktion ensimmäisessä vaiheessa rikki ja kloori reagoivat muodostaen dirikkidikloridia, joka reagoi edelleen kloorikaasun kanssa muodostaen rikkidikloridia. Jälkimmäinen reaktio on huoneenlämpötilassa hidas ja katalyytteinä käytetäänkin ferrikloridia tai jodia. Dirikkidikloridin ja kloorin reaktio on myös tasapainoreaktio. Pieni määrä fosforipentakloridia siirtää tasapainoa rikkidikloridin puolella. Kumpikin aineen valmistuksessa käytetyistä reaktioista ovat eksotermisiä.[2]
Reaktioita
muokkaaRikkidikloridia voidaan käyttää liittämään klooria tyydyttymättömien yhdisteiden kaksoissidoksiin. Ensimmäisen maailmansodan aikana rikkidikloridia käytettiin valmistettaessa sinappikaasun esiastetta 2-kloorietyylisulfenyylikloridia. [3]
Rikkidikloridia voidaan käyttää rikkitetrafluoridin valmistamiseen. Rikkidikloridi reagoi natriumfluoridin kanssa asetonitriililiuoksessa. [4]
Rikkidikloridi hajoaa hydroksidi-ionien vaikutuksesta, jolloin syntyy kloridi- ja tiosulfaatti-ioneja sekä vettä. [2]
- 2 SCl2 + 6 OH- → 4 Cl- + S2O32- + 3 H2O
Turvallisuus
muokkaaRikkidikloridi on myrkyllistä. Aineen hengittäminen aiheuttaa hengitysvaikeuksia ja kurkkukipua. Nieleminen saa aikaan huonoa oloa ja voi johtaa myös pyörtymiseen. Aine aiheuttaa vakavia syövytysvammoja joutuessaan kosketuksiin ihon tai silmien kanssa. Rikkidikloridi on myös haitallista ympäristölle ja erityisesti vesieliöille. [1]
Lähteet
muokkaa- ↑ a b c d e Rikkidikloridin kansainvälinen kemikaalikortti Viitattu 5.4.2009
- ↑ a b Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman: Inorganic chemistry, s. 529. Academic Press, 2001. ISBN 978-0-12-352651-9 Kirja Googlen teoshaussa Viitattu 5.4.2009. (englanniksi)
- ↑ Constance M. Pechura, David P. Rall: Veterans at Risk, s. 72. National Academies Press, 1993. ISBN 978-0-309-09001-8 Kirja Googlen teoshaussa Viitattu 5.4.2009. (englanniksi)
- ↑ Steve Mitchell: Biological interactions of sulfur compounds, s. 15. CRC Press, 1996. ISBN 978-0748402458 Kirja Googlen teoshaussa Viitattu 5.4.2009. (englanniksi)